Avez-vous déjà pensé au fonctionnement de votre téléphone portable, de votre voiture électrique ou même d'une simple pile ? Au cœur de ces technologies se cachent deux acteurs essentiels : la cathode et l'anode. Ces deux électrodes, aux propriétés opposées et complémentaires, sont à la base de nombreux processus électrochimiques qui alimentent notre monde moderne. Découvrons ensemble le rôle fascinant de ces deux composants.
L'électrochimie, l'étude des réactions chimiques impliquant le transfert d'électrons, est un domaine fondamental qui explore les interactions entre l'électricité et les réactions chimiques. La cathode et l'anode sont les deux pôles d'une cellule électrochimique, qu'il s'agisse d'une batterie, d'une cellule d'électrolyse ou d'une autre application. Comprendre leur fonctionnement est essentiel pour saisir les principes de l'électrochimie.
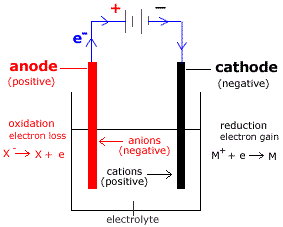
La cathode, pôle positif dans une pile en décharge, est l'électrode où se produit la réduction, c'est-à-dire le gain d'électrons. L'anode, pôle négatif dans une pile en décharge, est l'électrode où se produit l'oxydation, c'est-à-dire la perte d'électrons. Ce flux d'électrons entre l'anode et la cathode génère un courant électrique. Le rôle de ces électrodes s'inverse lors de la charge d'une batterie.
L'histoire de la cathode et de l'anode remonte aux travaux pionniers de scientifiques comme Alessandro Volta et Michael Faraday au début du XIXe siècle. Leurs découvertes sur les piles voltaïques et l'électrolyse ont jeté les bases de l'électrochimie moderne et ont permis le développement d'innombrables applications, des batteries aux revêtements métalliques en passant par la production d'aluminium.
Aujourd'hui, la cathode et l'anode sont au cœur de technologies clés pour l'avenir, comme les batteries pour véhicules électriques, le stockage d'énergie renouvelable et les piles à combustible. L'amélioration des performances des électrodes, notamment en termes de capacité, de durée de vie et de sécurité, est un enjeu majeur de la recherche actuelle. De nouveaux matériaux et architectures d'électrodes sont constamment explorés pour optimiser les performances des dispositifs électrochimiques.
Par exemple, dans une pile lithium-ion, la cathode est généralement composée d'un matériau à base d'oxyde de métal de transition lithié, tandis que l'anode est souvent en graphite. Lors de la décharge, les ions lithium migrent de l'anode vers la cathode, générant un courant électrique. Lors de la charge, le processus s'inverse.
Un défi majeur lié aux cathodes et aux anodes est leur dégradation au fil du temps, ce qui limite la durée de vie des batteries. La recherche se concentre sur le développement de matériaux plus résistants et de stratégies pour minimiser cette dégradation.
Quelques questions fréquemment posées :
1. Quelle est la différence entre une cathode et une anode ? Réponse : La cathode est l'électrode où a lieu la réduction, tandis que l'anode est l'électrode où a lieu l'oxydation.
2. Comment le courant circule-t-il entre la cathode et l'anode ? Réponse : Le courant circule grâce au mouvement des électrons de l'anode vers la cathode.
3. Quels matériaux sont utilisés pour fabriquer les cathodes et les anodes ? Réponse : Cela dépend de l'application, mais des matériaux courants incluent le graphite, les oxydes métalliques et les métaux.
4. Quelle est l'importance de la cathode et de l'anode dans les batteries ? Réponse : Elles sont essentielles pour le stockage et la libération d'énergie.
5. Quels sont les défis liés à la recherche sur les cathodes et les anodes ? Réponse : Améliorer la durée de vie, la capacité et la sécurité des batteries.
6. Comment fonctionne une cellule d'électrolyse avec une cathode et une anode? Réponse : Une cellule d'électrolyse utilise un courant électrique pour forcer une réaction chimique non spontanée, la réduction ayant lieu à la cathode et l'oxydation à l'anode.
7. Quel est le rôle de l'électrolyte dans un système cathode-anode? Réponse : L'électrolyte permet le passage des ions entre la cathode et l'anode, complétant le circuit électrique.
8. Peut-on inverser les rôles de la cathode et de l'anode? Réponse : Oui, dans une batterie rechargeable, les rôles s'inversent lors du processus de charge.
En conclusion, la cathode et l'anode sont des composants fondamentaux de nombreux dispositifs électrochimiques qui façonnent notre monde. Comprendre leur fonctionnement et les défis liés à leur développement est crucial pour progresser vers un avenir plus durable et technologiquement avancé. Des batteries de nos téléphones aux technologies de stockage d'énergie renouvelable, la cathode et l'anode jouent un rôle essentiel dans notre quotidien et continueront à influencer les innovations technologiques de demain. Encourager la recherche et le développement dans ce domaine est donc primordial pour répondre aux défis énergétiques et environnementaux actuels et futurs.
Cathode negative or positive - Trees By Bike
Vidéo question Identifier lanode ou la cathode sur la base dun - Trees By Bike
le cathode et l'anode - Trees By Bike
Différence entre Anode et Cathode - Trees By Bike
anode et cathode electrolyse - Trees By Bike
How to Identify Anode and Cathode of LED - Trees By Bike
le cathode et l'anode - Trees By Bike
Diode Led Controller at Reid Pearson blog - Trees By Bike
Électrode définition et explications - Trees By Bike
Diodo Anodo E Catodo - Trees By Bike
le cathode et l'anode - Trees By Bike
Pile de concentration où est anode et cathode - Trees By Bike
CHE 2C U1 Module 2 Flashcards - Trees By Bike
Anode and cathode scientific physics education diagram vector - Trees By Bike
LED find the Anode and the - Trees By Bike