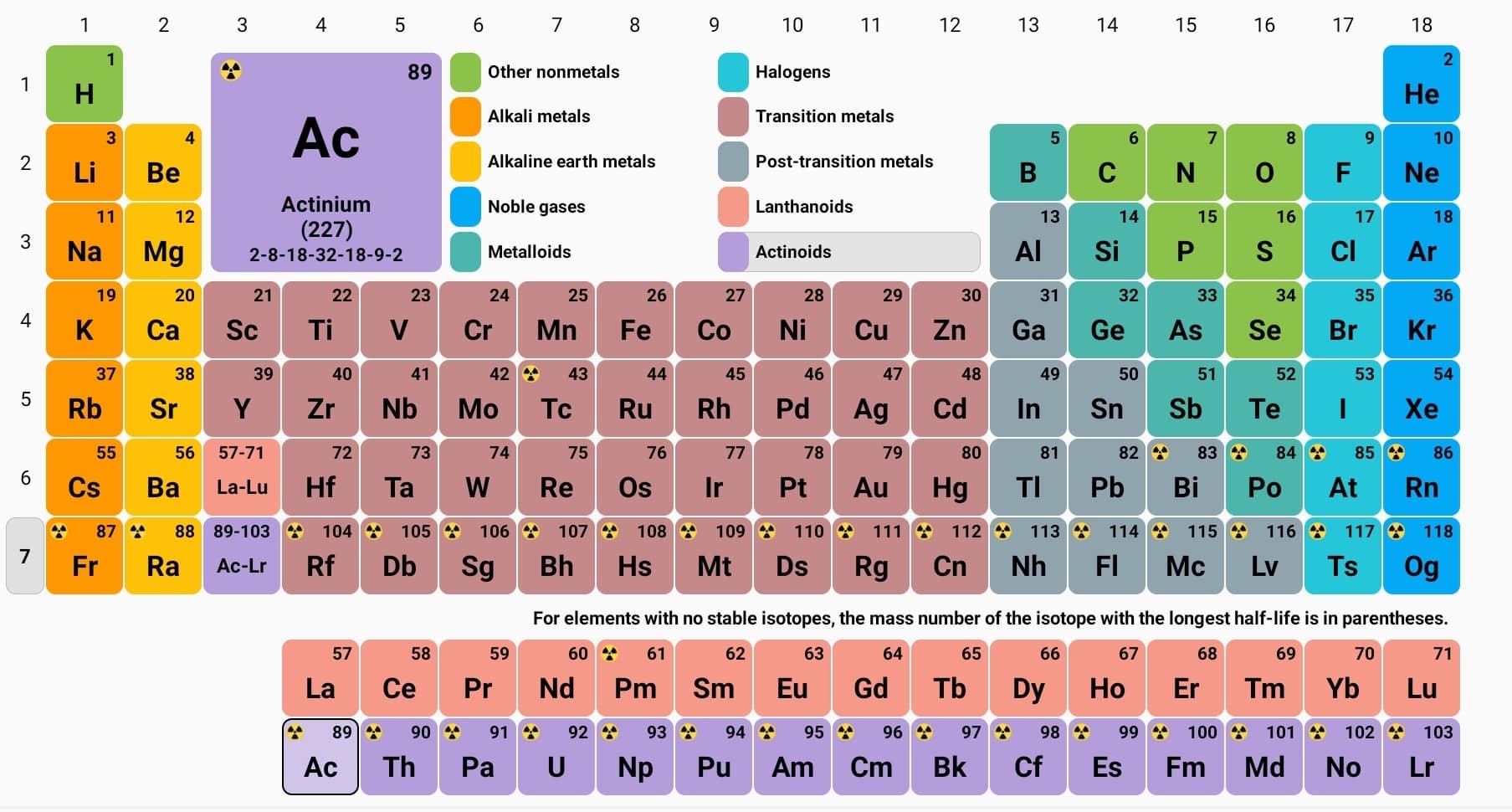
Ooit afgevraagd waarom sommige metalen zo glanzend zijn, of waarom bepaalde elementen zulke bijzondere chemische eigenschappen hebben? Het antwoord ligt vaak verscholen in het hart van het periodiek systeem: het d-blok. Deze fascinerende groep elementen, ook wel de overgangsmetalen genoemd, speelt een cruciale rol in talloze aspecten van ons leven, van de technologie in onze smartphones tot de processen in ons eigen lichaam.
Het periodiek systeem, een meesterwerk van ordening in de chemie, biedt een overzicht van alle bekende elementen, gerangschikt op basis van hun atoomnummer en elektronenconfiguratie. Het d-blok, gelegen tussen de s- en p-blokken, herbergt elementen met gedeeltelijk gevulde d-orbitalen. Deze specifieke elektronenconfiguratie geeft de overgangsmetalen hun unieke eigenschappen.
De ontdekking en ontwikkeling van het periodiek systeem is een verhaal van wetenschappelijke vooruitgang, met bijdragen van talloze briljante geesten. Van de vroege pogingen tot classificatie tot de moderne vorm van het periodiek systeem, de zoektocht naar orde in de chemische elementen heeft onze kennis van de materie enorm verrijkt. Het d-blok neemt een centrale plaats in binnen dit verhaal, en het begrijpen van de structuur en eigenschappen ervan is essentieel voor elke chemicus.
Het belang van het d-blok elementen in het periodiek systeem der elementen kan niet genoeg benadrukt worden. Deze metalen zijn essentieel voor een breed scala aan industriële processen, van de productie van staal en andere legeringen tot de ontwikkeling van katalysatoren voor chemische reacties. Daarnaast spelen d-blok elementen ook een cruciale rol in biologische systemen, waar ze functioneren als co-factoren in enzymen en betrokken zijn bij belangrijke biologische processen.
Maar de chemie van het d-blok is niet zonder uitdagingen. Het begrijpen van de complexe interacties tussen de d-elektronen en de resulterende chemische eigenschappen vereist diepgaande kennis van de kwantummechanica. Het voorspellen van het gedrag van d-blok elementen in verschillende chemische omgevingen blijft een actief onderzoeksgebied, met belangrijke implicaties voor de ontwikkeling van nieuwe materialen en technologieën.
De elementen in het d-blok staan bekend om hun variabele oxidatietoestanden, wat betekent dat ze elektronen kunnen afstaan of opnemen in verschillende chemische reacties. Deze eigenschap maakt ze veelzijdig in chemische processen. IJzer bijvoorbeeld kan voorkomen in oxidatietoestand +2 of +3, wat leidt tot verschillende chemische eigenschappen.
Een voorbeeld van de toepassingen van d-blok elementen is het gebruik van platina en palladium als katalysator in auto's. Deze metalen versnellen de omzetting van schadelijke uitlaatgassen in minder schadelijke stoffen.
Voor- en Nadelen van d-blok Elementen
Hoewel er geen directe voor- of nadelen zijn aan het d-blok *zelf*, kunnen we wel kijken naar de voor- en nadelen van het *gebruik* van d-blok elementen:
Veelgestelde Vragen over het d-blok:
1. Wat is het d-blok? Het d-blok is een sectie in het periodiek systeem der elementen die de overgangsmetalen bevat.
2. Waarom zijn d-blok elementen belangrijk? Ze zijn essentieel voor veel industriële en biologische processen.
3. Wat zijn enkele voorbeelden van d-blok elementen? IJzer, koper, goud, zilver, platina.
4. Wat is een oxidatietoestand? Het aantal elektronen dat een atoom heeft gewonnen of verloren in een chemische verbinding.
5. Waarom zijn overgangsmetalen vaak gekleurd? Door de d-elektronen en hun interactie met licht.
6. Wat is katalyse? Het proces waarbij een stof (katalysator) de snelheid van een chemische reactie beïnvloedt zonder zelf verbruikt te worden.
7. Waar worden d-blok elementen in de industrie gebruikt? In legeringen, katalysatoren, en elektronica.
8. Zijn alle d-blok elementen metalen? Ja.
Tips en trucs voor het leren over het d-blok: Gebruik een periodiek systeem, bestudeer de trends in eigenschappen, en oefen met het schrijven van elektronenconfiguraties.
Het d-blok in het periodiek systeem der elementen vertegenwoordigt een fascinerende en essentiële groep elementen. Van hun rol in industriële processen tot hun belang in biologische systemen, de overgangsmetalen beïnvloeden ons leven op talloze manieren. Het begrijpen van de eigenschappen en het gedrag van deze elementen is cruciaal voor de vooruitgang in de chemie, materiaalkunde en vele andere wetenschappelijke disciplines. Door verder onderzoek en innovatie kunnen we de potentie van het d-blok elementen blijven ontsluiten en nieuwe toepassingen ontwikkelen die onze wereld vormgeven. Verdiep je in de wonderen van het periodiek systeem en ontdek de schatten die het d-blok te bieden heeft. De chemie van deze elementen is complex, maar de beloning van begrip is enorm. Door te blijven leren en ontdekken, kunnen we de kracht van deze fascinerende elementen benutten en nieuwe mogelijkheden creëren voor de toekomst. De reis door het periodiek systeem is een reis door de bouwstenen van ons universum, en het d-blok is een onmisbare halte op deze spannende expeditie.
Periodic Table Of The ENGLISH Tabular Arrangement Of 118 - Trees By Bike
Families and Periods of the Periodic Table - Trees By Bike
Periodic Table With Mnemonics - Trees By Bike
A Horizontal Row Of Blocks In The Periodic Table Is Called N - Trees By Bike
Periodic Table D Block Elements Names - Trees By Bike
periodic table of elements d block - Trees By Bike
Colorful Periodic Table Of Chemical Elements Beautiful Shape Science - Trees By Bike
Electron Configurations A Must Know Hack - Trees By Bike
Periodic Table D Block Elements Names - Trees By Bike
Blocks in periodic table Study Guide - Trees By Bike
d block elements name list useful properties - Trees By Bike
6 Cool Ways to Learn Periodic Table - Trees By Bike
Tableau Chart With Blocks - Trees By Bike
Oxygen Block In Periodic Table at Tammy Reed blog - Trees By Bike
Helium S Periodic Table Neighbor - Trees By Bike